骨に取り込まれる機構の全容は明らかではありませんが、骨親和性物質の集積増加がみられる病変部には血流の増加があることが知られています。また、陰イオンとしての性質を有することから、骨のhydroxyapatite結晶にイオン結合することにより、骨、ことに骨新生の盛んな部分に多く集まるものと考えられています1,2)。

ご利用にあたっての注意
「核医学(製品関連)FAQ」は、医療関係者の方を対象に、弊社製品をご使用いただく際の参考情報を提供することを目的としています。
ご使用者の判断と責任においてご活用いただき、その結果については責任を負いかねますので、あらかじめご了承ください。
製品のご使用にあたっては、最新の添付文書をご確認いただきますようお願いします。
本FAQを許可なく複写、複製、転掲、改変等を行うことはご遠慮ください。
製品についてご不明な点がございましたら、弊社製品お問い合わせ専用フリーダイヤル( 0120-076-941)にお問い合わせください。
0120-076-941)にお問い合わせください。
製品情報についてのお問い合わせ
- TEL:0120-076-941 受付時間:9:00~17:30(土・日・祝日・当社休業日を除く)
- FAX:03-5634-5173
- *お急ぎでない場合は、お問い合せフォームからご質問いただけます。
- *医療用医薬品をお取り扱いしておりますので、一般の方からのお問い合わせはお受けしておりません。お問い合わせは受診されている医療機関へお願いいたします。
- お問い合わせフォーム
![[別ウィンドウ]](/sites/default/images/corpo/common/img/icon/window-01.png)
2) クリアボーンキット 添付文書(第1版), 2022改訂
各種骨疾患患者(男女 各3例)に99mTc-HMDPを370~925MBq静注後、30、60、120分及び180分のうち、2ないし3回採尿して、その放射能を測定した結果、尿中排泄率は、投与後2時間まで増加し、以後増加はほとんどみられませんでした。男女の違いは認めず、投与後2時間で約40%が尿中に排泄されました1)。
各種骨疾患患者について試験した結果、99mTc-HMDP投与後の血中クリアランスは投与後30分までは急速な減少を示し、それ以降はややゆっくりと減少しました(2時間後:約7%)1,2)。
2) クリアボーンキット 添付文書(第1版), 2022改訂
[成人]
前面像では、前部頭蓋・顔面骨・下顎骨・鎖骨・胸骨・上前腸骨棘・恥骨など前面にある骨格部分がよく描出されます。後面像では、後部頭蓋・全脊椎骨・肩甲骨・仙腸関節・腸骨翼・坐骨など後面にある骨格部分がよく描出されます。脊椎骨と仙腸関節の取り込みはほぼ等しく、他の部位より集積が目立ちます1)。また、排泄経路が尿路系であるため、腎と膀胱も描出されます2)。
正常像(40歳代、女性)
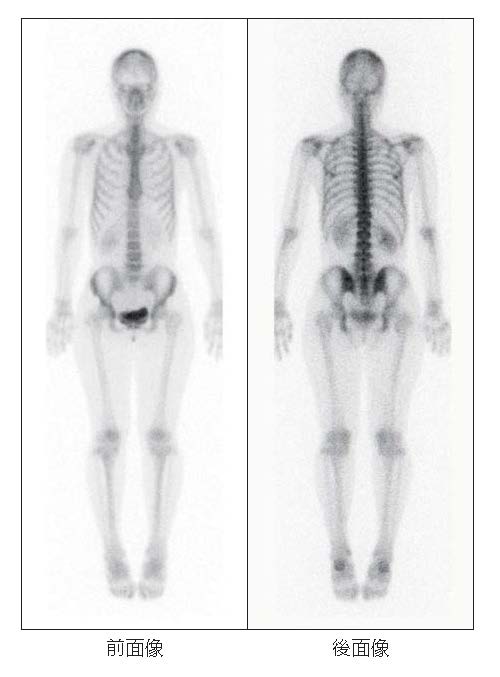
【症例報告者】 大阪市立大学 河邉讓治先生
[小児]
小児では骨成長端でのミネラルターンオーバーが盛んなことから骨端での集積が高いです3)。
2) 牧 正子 : 腎と透析 43:915-917, 1997
3) 久保 敦司 他 : シンチグラムアトラス-正常像とピットフォール- p.122-138, 1997
日本核医学会・日本核医学技術学会・日本診療放射線技師会・日本病院薬剤師会「放射性医薬品取扱いガイドライン 第3.1版」1)の「付録1.放射性医薬品調製手順書 第1章 調製時の一般的注意」には以下のように記載されています。
(7) 調製後の溶液を希釈しない。
調製後の溶液を希釈すると99mTc放射性医薬品の分解が起こり、放射化学的純度が低下することがある。薬剤の放射能量を調整する時は、調製前に真空バイアル等を使用し、必要量の99mTcO4-ナトリウム注射液に日本薬局方注射用生理食塩液を加えて、あらかじめ放射能量を調整してから薬剤の調製を行う。
調製前に、過テクネチウム酸ナトリウム(99mTc)注射液を日本薬局方生理食塩液で希釈して適切な濃度に調整して1,2)から、3~9mLを調製に用いてください2)。
日本核医学会・日本核医学技術学会・日本診療放射線技師会・日本病院薬剤師会「放射性医薬品取扱いガイドライン 第3.1版」1)の「付録1.放射性医薬品調製手順書 第1章 調製時の一般的注意」には以下のように記載されています。
(6) 標識後のキット製剤に99mTcO4-ナトリウム注射液を追加しない。
調製完了後のキット製剤の放射能量が不足しているからといって、そこに99mTcO4-ナトリウム注射液を追加しても、還元剤や配位子(薬剤)が既に反応を完了しているため、追加された99mTcO4-ナトリウムとの反応が進行せずに標識低下を起こす恐れがある。
調製前に、過テクネチウム酸ナトリウム(99mTc)注射液を適切な濃度に調整して1,2)から、3~9mLを調製に用いてください2)。
急性期心筋梗塞の障害部位やアミロイドーシス、炎症(心膜炎、心内膜炎、心筋炎)、石灰化(心膜の石灰化、弁の石灰化、腎不全や透析による石灰化)、心室瘤、狭心症で報告があります1,2)。
また、前立腺癌3)、腫瘍の浸潤4)、心嚢液貯留5)、電気的除細動後6)等の文献報告もあります。
2) 久保 敦司 他 : シンチグラムアトラス-正常像とピットフォール- p.122-138, 1997
3) 田所 研一郎 他 : 日本冠疾患学会雑誌 10:212-215, 2004
4) Phillips CD 他 : Clin Nucl Med 12:899-900, 1987
5) 出口 清吾 他 : 血液・腫瘍科 22:594-599, 1991
6) Palestro CJ 他 : Clin Nucl Med 16:273-274, 1991
びまん性骨転移を来した例で、四肢骨への集積が低下するSuper Bone Scan※を認めたとの報告1,2)があります。
※Super Bone Scan(Beautiful Bone Scan) : 全身骨への集積が増加した状態をいい、骨への集積が著明なため腎への集積が認められない所見(Absent Kidney Sign)を伴うことが多い3)。
2) 太平 周作 他 : 日本臨床外科学会誌 61:106-110, 2000
3) 小泉 満 他 : 全身骨転移を探る-骨シンチグラフィ- p.39-42, 2000

