ドパミントランスポーターは黒質線条体ドパミン神経の終末部が位置する線条体に高発現します。ラット脳内分布試験、in vivo結合阻害/置換試験、及びパーキンソン病モデルサルを作成して実施したSPECT評価の各種試験の結果、123I-FP-CITは線条体に高い集積を示し、その集積がドパミントランスポーターへの結合を反映したものであることが示されています1)。

ご利用にあたっての注意
「核医学(製品関連)FAQ」は、医療関係者の方を対象に、弊社製品をご使用いただく際の参考情報を提供することを目的としています。
ご使用者の判断と責任においてご活用いただき、その結果については責任を負いかねますので、あらかじめご了承ください。
製品のご使用にあたっては、最新の添付文書をご確認いただきますようお願いします。
本FAQを許可なく複写、複製、転掲、改変等を行うことはご遠慮ください。
製品についてご不明な点がございましたら、弊社製品お問い合わせ専用フリーダイヤル( 0120-076-941)にお問い合わせください。
0120-076-941)にお問い合わせください。
製品情報についてのお問い合わせ
- TEL:0120-076-941 受付時間:9:00~17:30(土・日・祝日・当社休業日を除く)
- FAX:03-5634-5173
- *お急ぎでない場合は、お問い合せフォームからご質問いただけます。
- *医療用医薬品をお取り扱いしておりますので、一般の方からのお問い合わせはお受けしておりません。お問い合わせは受診されている医療機関へお願いいたします。
- お問い合わせフォーム
![[別ウィンドウ]](/sites/default/images/corpo/common/img/icon/window-01.png)
主に尿中へ排泄されます1)。
国内及び海外の第Ⅰ相臨床試験において、健康成人に123I-FP-CITを静脈内投与した際の累積尿中放射能排泄率を以下に示します(下表参照)。
投与後1時間から尿中への移行が確認され、累積尿中放射能排泄率は投与後5時間で約8~11% ID※、2日で約41~60% IDでした1)。
表.累積尿中放射能排泄率(% ID※) ※ ID : 投与量(Injected Dose)
|
投与後時間 |
2.5時間 |
5時間 |
24時間 |
48時間 |
|
|---|---|---|---|---|---|
|
国内(n=12) |
4.15±2.48 |
7.90±3.23 |
26.24±5.47 |
41.11±6.26 |
|
|
投与後時間 |
2時間 |
3時間 |
5時間 |
24時間 |
48時間 |
|
海外(n=12) |
3.08±2.20 |
5.99±2.00 |
10.96±4.06 |
37.56±7.59 |
59.89±9.50 |
平均値±標準偏差
国内 : NMA98P1 試験、海外 : CY95.FP.Ⅰ試験
有効半減期は約7.6時間との報告1)があります。この値を以下の算出式2)に当てはめて計算した生物学的半減期は、約17.9時間です。
1/有効半減期=1/物理学的半減期+1/生物学的半減期
(物理学的半減期は13.2時間で計算)
健常人での検討において、甲状腺の被曝の原因となる遊離のヨウ素イオン(123I-)が、血漿中及び尿中に認められなかったことから、末梢組織での脱ヨウ素はごくわずかであると推察されています1)。
(参考)
甲状腺ブロックを行わずに実施された動物(ヒヒ)での体内動態の検討において、甲状腺への集積はバックグラウンドと比較して有意差がなかったとの報告2)があります。
2) Baldwin RM 他 : Nucl Med Biol 22:211-219, 1995
米国の添付文書の薬物相互作用に記載されている薬剤のうち、国内で承認されている薬剤について、併用注意を設定し、添付文書1)の「10. 相互作用」に以下のように記載しています。
10.2 併用注意(併用に注意すること)
|
薬剤名等 |
臨床症状・措置方法 |
機序・危険因子 |
|---|---|---|
|
選択的セロトニン再取り込み阻害薬 ・フルボキサミンマレイン酸塩 |
線条体と背景組織における本剤の集積比が上昇する可能性がある。画像を評価する際に留意すること。 |
本剤は背景組織に発現するセロトニントランスポーターにも結合するため、背景組織における本剤の集積が低下する可能性がある。 |
|
中枢神経刺刺激薬 ・メチルフェニデート塩酸塩 三環系抗うつ剤 ・アモキサピン 食欲抑制剤 ・マジンドール コカイン系製剤 ・コカイン塩酸塩 中枢興奮剤 ・メタンフェタミン塩酸塩 |
線条体における本剤の集積低下の原因となる可能性がある。画像を評価する際に留意すること。 |
線条体における本剤の特異的結合を競合的に阻害する可能性がある。 |
なお、事前に注意しておくべき薬剤や休薬の目安については、日本核医学会・日本脳神経核医学研究会の「イオフルパン診療ガイドライン」 2)の「2. 薬剤概要と臨床的適応 (6)検査への準備 1)事前チェック」及び「表3 イオフルパンSPECTに影響を与えうる薬」にも記載があります。
詳しくはイオフルパン診療ガイドラインをご参照ください。
日本核医学会・日本脳神経核医学研究会の「イオフルパン診療ガイドライン」1)には投与の可否に関する記述はありません。欧州核医学会/米国核医学会の「EANM practice guideline/SNMMI procedure standard for dopaminergic imaging in Parkinsonian syndromes 1.0」2)では、患者が、閉所恐怖症やじっとしていることができない場合には、イメージング前に短時間作用型ベンゾジアゼピン系鎮静剤の投与を行い、これによる画質および定量にあたえる影響はないと考えられるとの記載があります。
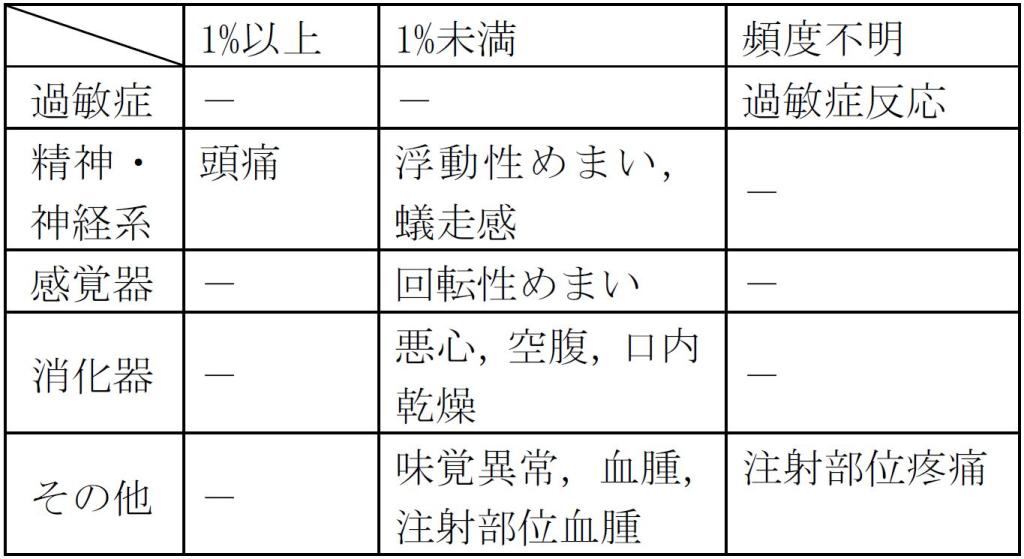
添付文書1)の「11. 副作用」(一部抜粋)及び「17. 臨床成績」(一部抜粋)には以下のように記載しています。
11.1 重大な副作用
11.1.1 過敏症(頻度不明)
投与後局所反応(0.1%)、そう痒及び紅斑等の過敏症(頻度不明)があらわれることがある。
11.2 その他の副作用
17.1 有効性及び安全性に関する試験
17.1.1 国内第Ⅲ相試験(NMA78P3-1試験)
安全性解析対象24例に対し、副作用は認められなかった。
17.1.2 海外第Ⅲ相試験(DP008-003試験)
副作用発現頻度は7%(15/224例)であり、1%以上に認められた副作用は、頭痛8例、回転性めまい、空腹及び蟻走感が各3例であった。
17.1.3 海外第Ⅲ相試験(PDT304試験)
副作用発現頻度は7%(13/179例)であり、1%以上に認められた副作用は、頭痛5例、悪心3例、注射部位血腫、浮動性めまい及び味覚異常が各2例であった。
17.1.4 国内第Ⅲ相試験(NMA78P3-2 試験)
安全性解析対象18例に対し、副作用は認められなかった。
17.1.5 海外第Ⅲ相試験(PDT301 試験)
副作用発現頻度は3%(9/326例)であり、1%未満に認められた副作用は、悪心3例、血腫2例、口内乾燥、嘔吐、注射部位紅斑、頭痛及び紅斑が各1例であった。
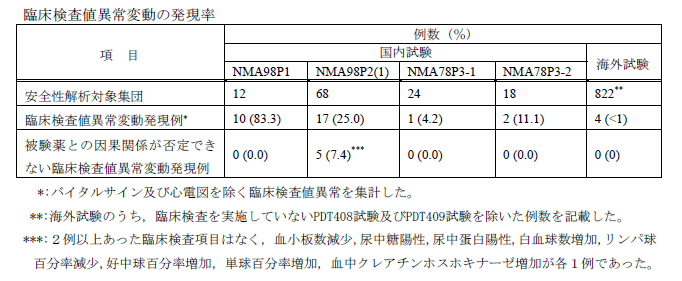
なお、海外8試験(822例)の併合解析を行った統合安全性概要(ISS)では、血液学的検査、血液生化学検査及び尿検査のいずれの項目についても、123I-FP-CIT投与前後で臨床的に重要と考えられる変動はありませんでした。国内試験(122例)では被検薬との因果関係が否定できない臨床検査値異常が5例ありましたが、異常値が2例以上の検査項目はなく、血小板数減少、尿中糖陽性、尿中蛋白陽性、白血球数増加、リンパ球百分率減少、好中球百分率増加、単球百分率増加、血中クレアチンホスホキナーゼ増加が各1例でした2)。