
1. 心筋SPECTの 適正画像を作るために
座長
工藤 崇 先生
長崎大学
皿井 正義 先生
藤田医科大学
演者
森 一晃 先生
虎の門病院
心筋SPECT画像の作成は、投影データ収集、画像再構成、心筋血流および心機能解析の流れで行われる(図1)。

【図1】
一律な収集条件、解析処理による標準化が望まれるところであるが、SPECT装置の多様化や各プロセスの条件は多岐にわたることから標準化は難しいのが現状である。また、画像処理は自動化が進んでいるが、画像再構成やデータ解析では操作者が介入するため、個人差が生じるという課題もある。本講演では、適切な心筋SPECT画像を作成するために注意すべきポイントについて解説する。
逐次近似画像再構成法(Ordered subset expectation maximization method: OS-EM法)を用いた再構成の普及により、収集カウントを強く意識しなくても良好な画像が作成できるようになったが、解析に適した精度の高い画像を得るためには、十分な収集カウントが求められる。当院の検査では、201TlCl、低エネルギー汎用型コリメータを用い、L型近接配置で180度、36方向の投影データを収集している。収集時間は45~60秒/view、総撮像時間は18分程度である。
放射性医薬品の心筋集積には個人差があり、一律の撮像条件では収集カウントにばらつきが生じる。ばらつきを軽減する手法として、当院では、収集時間の設定に、位置決めモニターに表示される計数率(count rate)を活用している。モニター上で心筋部および心筋外の集積状況、注射漏れの有無を確認して心臓への集積を予測し、表示計数率6~8kcts/sで50sec/viewを目安に収集時間を決定している。また、患者の体格と表示された心臓の大きさから収集拡大率を調整し、分解能を確保する。収集カウントに影響を及ぼす因子には放射性医薬品の投与量、患者の体格および体重、システム感度(ピクセルサイズ、コリメータ)、負荷方法(アデノシン負荷または運動負荷のみ)がある。SPECTデータ収集ではこれらの因子を考慮し、個別に適切な収集時間を設定することで、安定した収集カウントが見込める。
心筋SPECTの画像再構成は図2に示すプロセスで行われる。最近は全行程を自動処理により画像が作られるが、各プロセスにおいて正しく処理が行われているかを確認することが重要である。
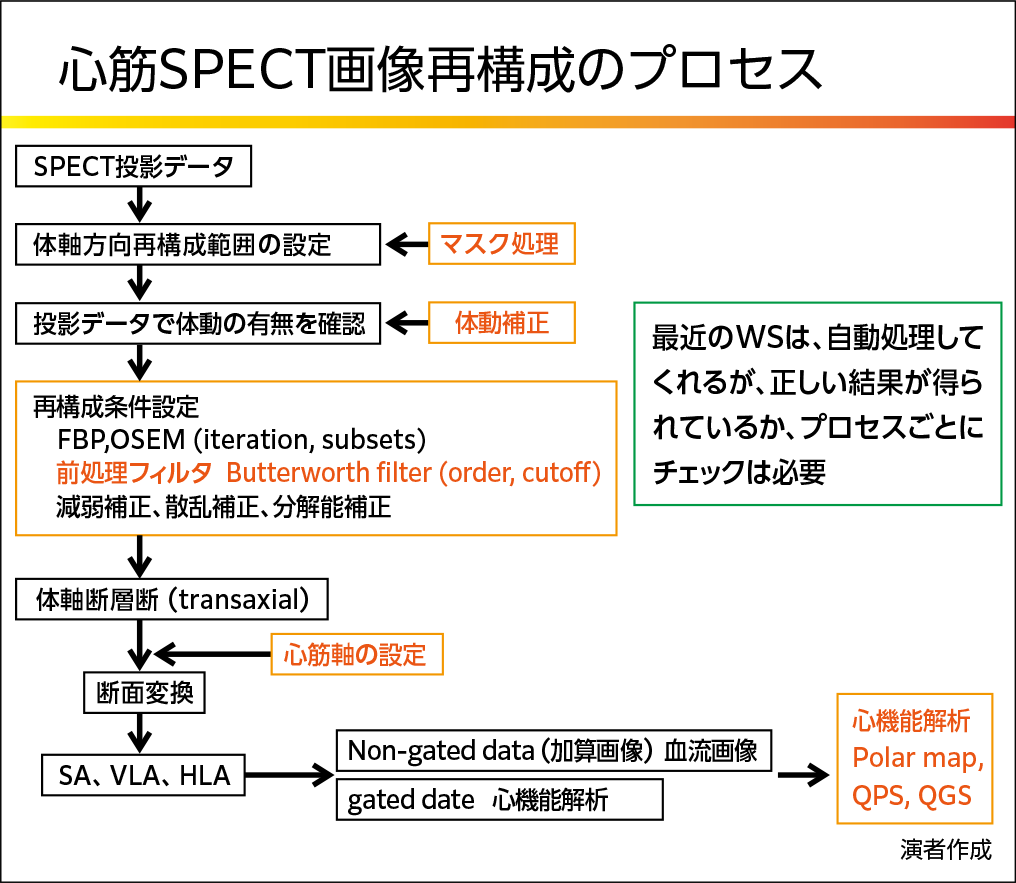
【図2】
まず体軸方向再構成範囲を設定する。この過程ではマスク処理により心筋外集積を除外し、最大カウントが心筋内にくるよう調整する。
体動の有無は、投影像をシネ表示して目視確認、sinogramやlinogramの連続性で評価する。体動が認められた合は体動補正プログラムでx、y方向の動きを補正する。体動が激しい場合には、再撮像も考慮する。また体動補正を行った場合は読影者にその旨を伝え、必要に応じて補正前後の画像を提示することも重要である。体動によるアーチファクトを見抜くには、図3に示す内容がポイントとして挙げられる。
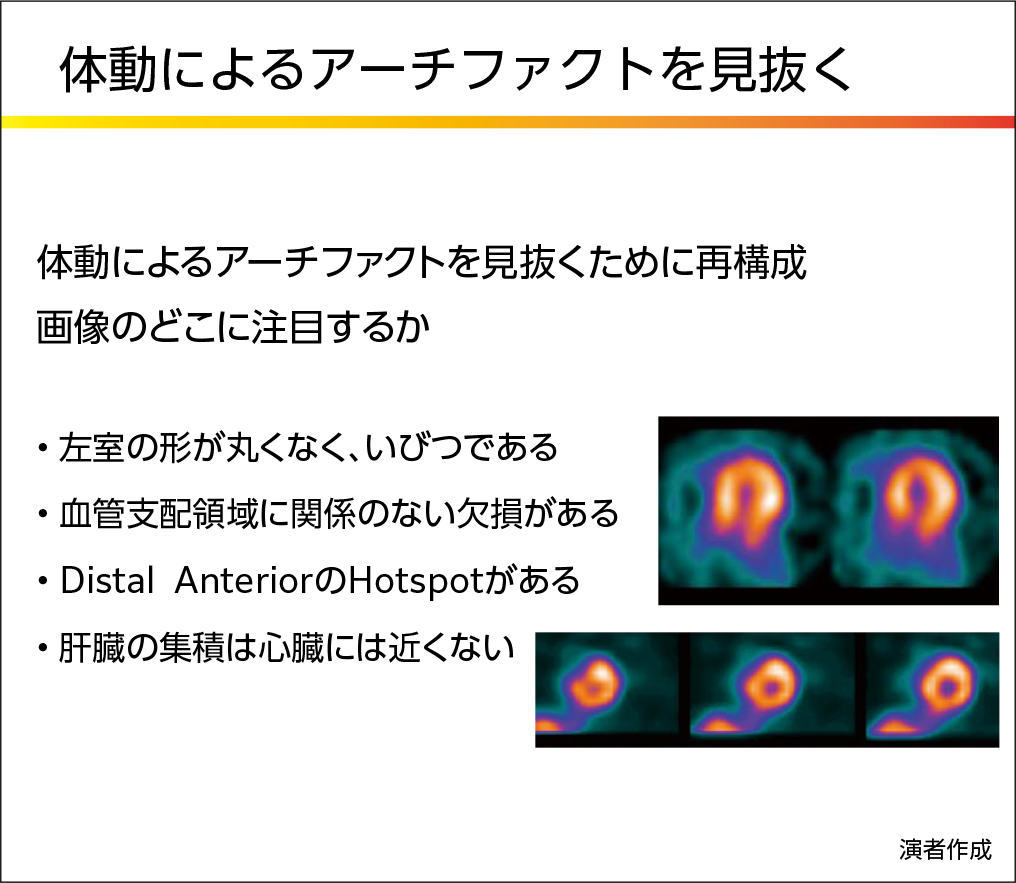
【図3】
SPECT再構成法はフィルタ補正逆投影(FBP : filtered backprojection)法または OS-EM法が使われる。まずは、前処理フィルタ(一般的にButterworth filterが用いられる)による投影データの統計ノイズ低減を行ったのちに再構成を行う。Butterworth filterの強度を決めるパラメータには遮断周波数(カットオフ値)と次数(order)があり、カットオフ値の方が画質に大きく影響する。収集カウントの多少に沿ってカットオフ値は個別に設定するのが望ましいが、操作者間の誤差を考慮し、固定値を用いることもある。カットオフ値の影響を小さくするためには、十分な収集カウントが必要で、S/N比が確保できる値(1ピクセルあたり100counts以上)になるような収集条件を設定することが望ましい。
体軸断層像が得られたら、心軸を設定し、垂直長軸断面、水平長軸断面、短軸断面へ断面変換を行う。断面変換では、心内腔が最も広く見えるスライスを選択し、心尖部先端と心内腔の中心を通る直線を心軸とする。その直線に直交する直線が短軸断面となる。このとき負荷時と安静時で断面位置が一致していることが重要である。広範囲に欠損がある場合には、画像表示のupperスケールを極端に下げ、心内腔部を線状に描出させる等の工夫をして再現性良く心軸を設定する。
心電図同期SPECT解析ソフトウェア(QGS)、心筋血流SPECT解析ソフトウェア(QPS)を用いて心機能や心筋血流分布を解析する。
QGSは、自動輪郭抽出された心筋壁の動きから左室機能指標を算出する。QGSの解析に影響を及ぼす因子として、不整脈、R-R分割数、小心臓、心筋外高集積、広範囲の欠損、左室肥大等があげられる。不整脈症例で収集心拍数の許容範囲の設定がポイントとなる。小心臓では収縮時の内膜の輪郭が正しく抽出されず収縮末期容積が過小評価される傾向があるため、収集マトリクスサイズの調整や拡大率をあげるなどの、空間分解能が高くなるような工夫が求められる。心筋外高集積例では、輪郭が適切に抽出されているか確認し、必要に応じて手動処理を行う。このとき心尖部や心基部の位置も変化して、容積が変動することに注意を払う必要がある。
QPSでは視覚的スコアリングのほかに日本核医学会の標準データベースに基づく自動スコアリングを使用することもできるが、視覚的スコアリングと一致しないケースもある。自動スコアリングは心尖部、心基部の設定によって、大きくスコアが変動することもあるので、自動輪郭設定を過信せず、心尖部、心基部位置が正しいかを確認することが重要である。負荷時合計欠損スコア(SSS : summed stress score)5~13の症例では、スコアの変動によって冠動脈疾患の重症度カテゴリーが変わってしまうため特に注意する。
画像作成プロセスの自動化が進んでいるが、まずは投影データ収集では十分な収集カウントが得られる設定にし、画像再構成やデータ解析では自動処理を過信せず、設定条件、処理結果が適切であるかを常に確認することが重要である。データ処理はときに主観的であるため、手動処理は慎重に行うべきである。解析値の信頼性を担保するためには、解析原理・適用条件・解析方法・誤差要因等を十分に理解したうえで結果を評価する必要がある(図4)。

【図4】