
(※認証番号:301ADBZX00045000)
PCIの効果を最大化する条件とは
~虚血評価からリスク評価の時代へ~
監修
松尾 仁司 先生
岐阜ハートセンター 院長
COURAGE試験1)、BARI-2D試験2)、ISCHEMIA試験3)などにおいて、安定冠動脈疾患に対する血行再建は薬物治療に対して優位性を示すことができなかった。しかし、安定冠動脈疾患に対するPCIが否定されたわけではない。
また、虚血の重症度を血行再建の根拠とする考え方に疑問が投げかけられているが、そもそも、安定冠動脈疾患に対する血行再建は虚血の解除が目的であり、虚血の重症度がリスク層別化に有用であるというエビデンスが豊富にあることを考慮すれば、虚血評価が否定されているわけではない。
また、虚血を伴わないが将来ACSを発症するリスクが高い、すなわち“破綻しやすいプラーク”に対するPCIの妥当性は示されていない。
このような状況の中で、PCI によって生命予後を改善できる患者をどのように同定して、PCI効果を最大化できるか、考察してみたい。
Hachamovitchらは、心筋血流SPECTで虚血心筋量が10%以上(中等度以上)の場合、薬物治療より血行再建の方が心臓死リスクを低減すると報告し4)、これはISCHEMIA試験で中等度以上の虚血患者を対象とする根拠となったと言われている。
しかし、その後、血行再建の技術と薬物治療が進歩し、生命予後を改善する虚血心筋量のカットオフ値も変化している可能性がある。心筋血流SPECTを施行した43,443例を1998‒2002年、2003‒2008年、2009‒2017年の3群に分けて分析した結果、血行再建が死亡率を低下させる虚血心筋量のカットオフ値は、それぞれ9.1%、9.2%、12.7%と経時的に上昇していた(図1)5)。スタチン、降圧薬、アスピリンの使用増加が、この上昇の要因と考えられる5)。
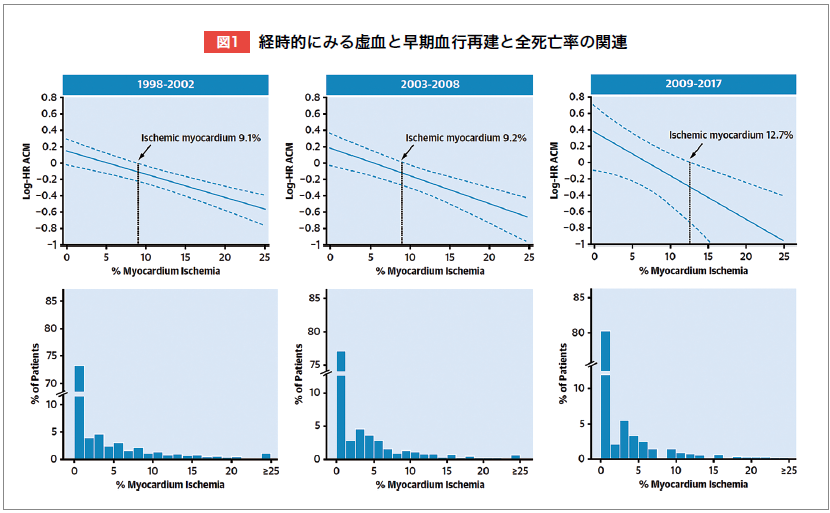
そもそも虚血心筋量だけで血行再建が予後を改善する患者を同定することに限界があるのではないだろうか?
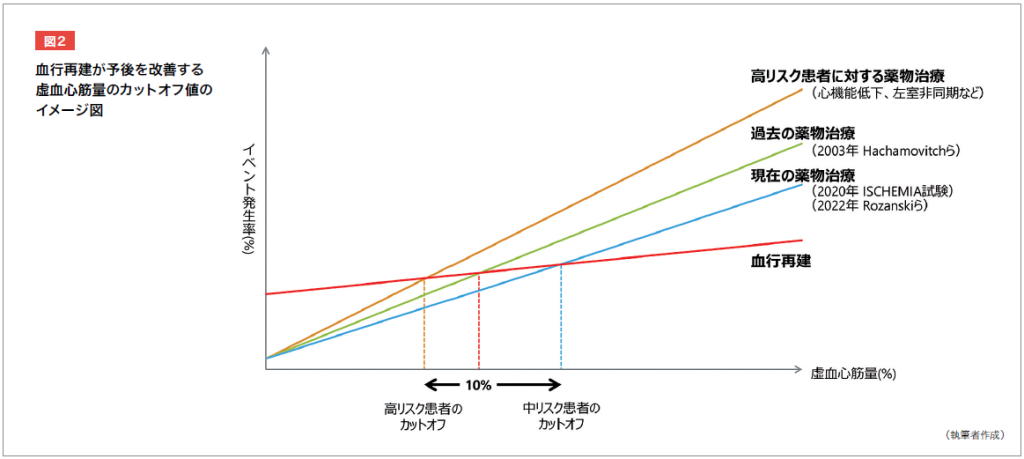
薬物治療の進歩によりイベント発生率が低下している場合、血行再建が予後を改善する虚血心筋量のカットオフ値は高くなると推察できる。一方で、心血管イベントのリスクが高い患者では、カットオフ値は低くなる(図2)。
つまり、PCIの効果を最大化するには、虚血心筋量に加えて心血管イベントのリスク因子を考慮し、リスクの高い患者を同定することが求められている。
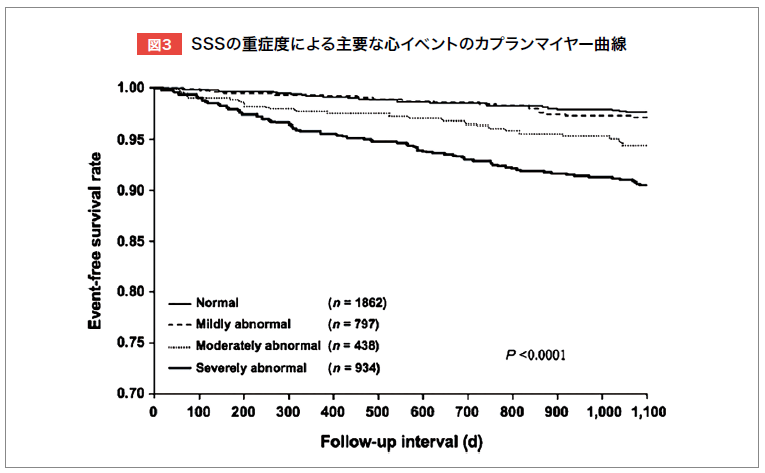
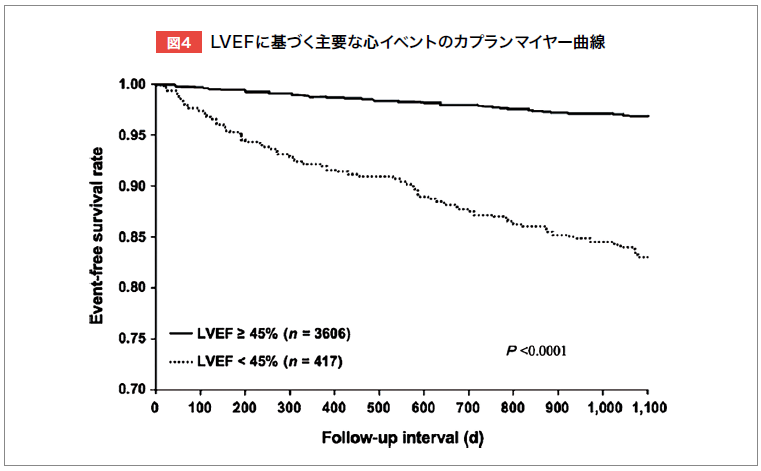
国内多施設共同研究J-ACCESSでは、虚血性心疾患またはその疑いのある日本人患者4,629例(117施設)を対象に、99mTctetrofosmin負荷・安静時心電図同期心筋血流SPECTを実施し、3年間の前向き追跡調査を行った。その結果、負荷時心筋血流合計スコア(SSS)や左室駆出率(LVEF)によって、主要心イベント(心臓死・非致死性心筋梗塞・心不全入院)のリスク層別化が可能であることが示された(図3,4)6)。
Coxハザードモデルによる多変量解析では、年齢、糖尿病、SSSの重症度、収縮末期容積(ESV)、LVEFが独立した予後予測因子であり6)、サブ解析ではeGFRも重要な予測因子であることが明らかとなった7)。
心電図同期心筋血流SPECT解析ソフト「Heart Risk View-F(HRV-F)」は、心機能指標に加え、位相解析により左室同期不全指標(Phase SD、Bandwidth、Entropy)を算出できる。
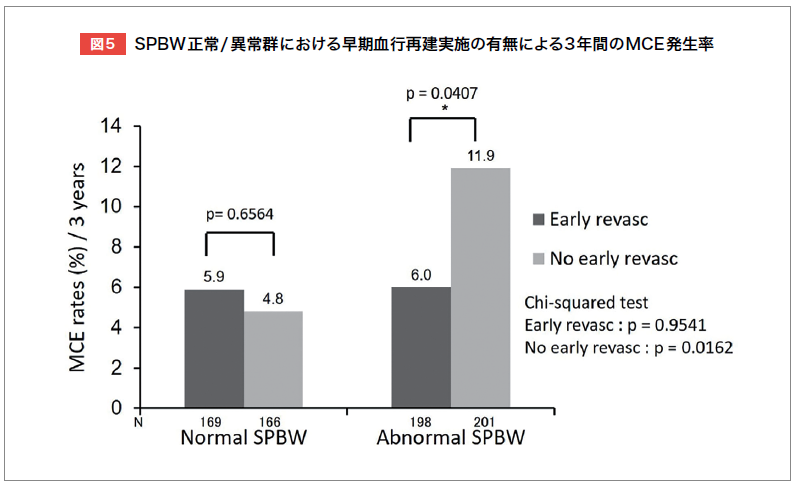
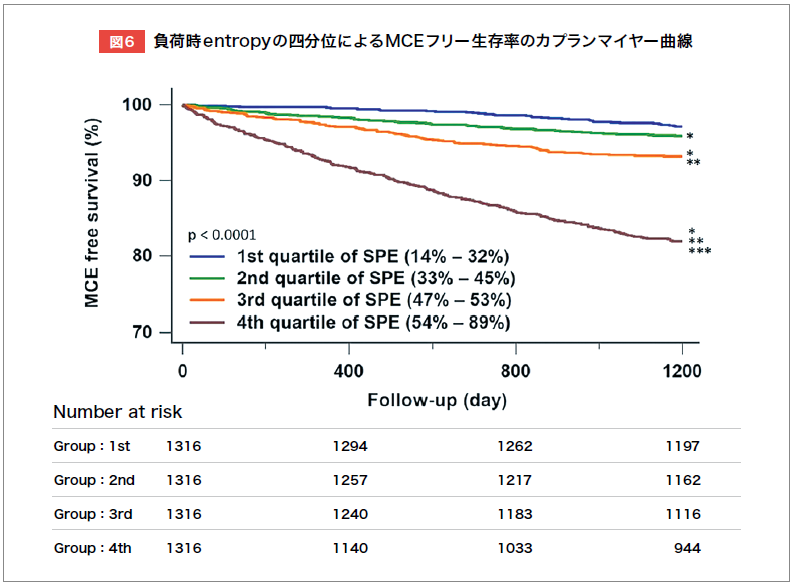
Tanakaらは、J-ACCESSリスクモデルに基づき、主要な心イベント(MCE)リスクが中等度(3~9%/3年)の冠動脈疾患(CAD)、またはその疑いの患者2,053例を対象に、HRV-Fによる負荷時Bandwidth(SPBW)が正常上限38°を超える場合、早期血行再建実施群の方が非実施群よりMCE発生率が有意に低いと報告した(図5)8)。 Fukumotoらは、既知のCAD 、またはその疑いの患者5,541例を対象に3年間の後ろ向き調査を行い、負荷時Entropyが高いほど予後不良であることを示した(図6)9)。多変量解析では、年齢、糖尿病、eGFR、負荷時LVEF、負荷時Entropyが主要な心イベントの独立予測因子であった9)。
無作為化比較試験はエビデンス構築のため中心的な役割を担う重要な手法であることは間違いないが、研究参加医師が相対的にリスクの低い患者を選択するバイアスが生じる可能性がある。イタリアにおける安定冠動脈疾患のコホート研究START registryの登録患者5,070名を対象とした検討では、ISCHEMIA試験の採用基準に適合しない患者群4,877名(96.2%)は、適合する患者群193名(3.8%)に比べてプライマリーアウトカム(心血管死、心筋梗塞、不安定狭心症または心不全による入院の複合指標)のリスクが有意に高く10)、実臨床ではISCHEMIA試験の採用基準に適合しない心血管イベントのリスクが高い患者が多く存在することが示された。
Post ISCHEMIA試験時代において、PCIの効果を最大化するために、心血管イベントのリスクが高い患者を同定することが求められている。心電図同期心筋血流SPECTは、ひとつの検査で虚血の重症度に留まらず心機能や左室同期不全を評価できるため、安定冠動脈疾患の管理に欠かせないモダリティである。
日本人におけるリスク層別化エビデンスを簡便に臨床利用できる
Heart Risk View-S
Heart Risk View-S(HRV-S)は、心筋血流SPECT 画像のPolar map解析ツールである。
各種解析に加え、日本人データJ-ACCESSa-b)に基づく回帰式c-d)により、年齢、糖尿病、SSS 重症度、心機能指標(ESVまたはLVEF)、eGFRを用いて3年以内の心事故発生確率を算出できる。算出された確率の妥当性は複数の報告で確認されているe-g)。
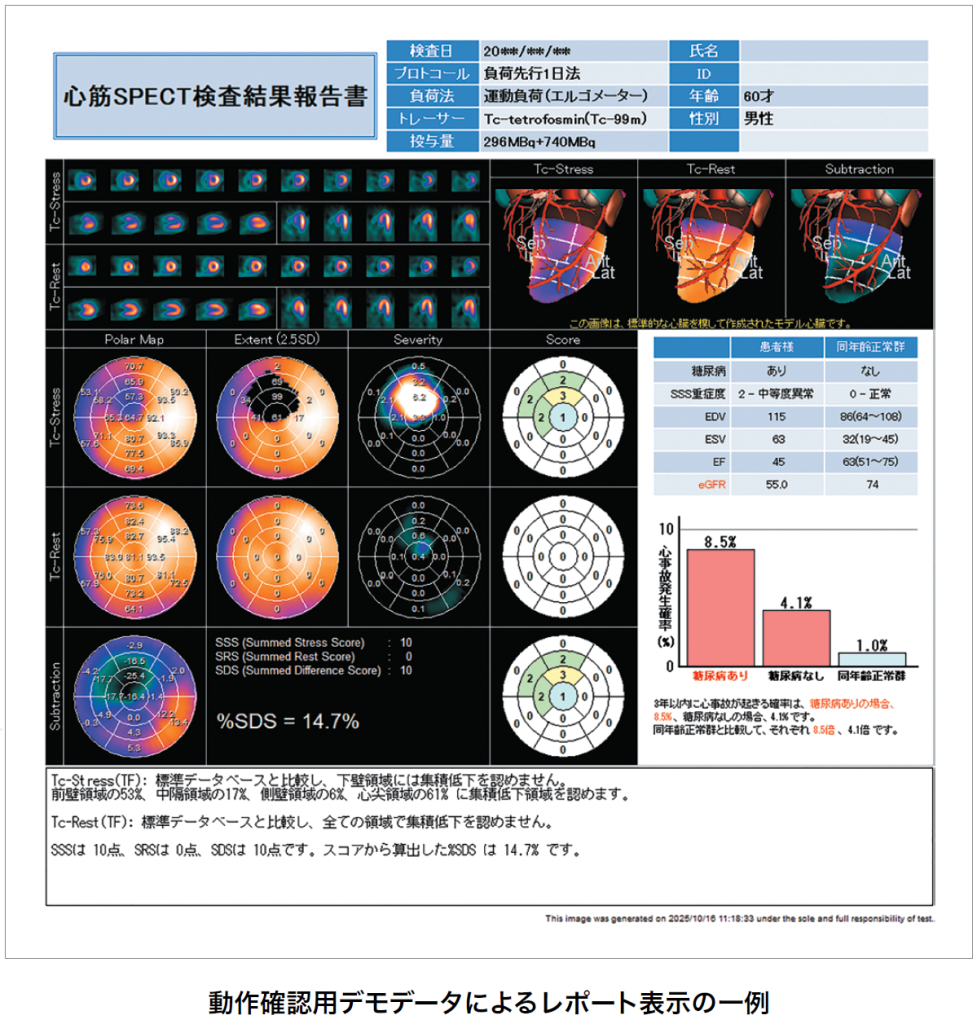
さらなる詳細なリスク層別化により治療方針の考慮に役立つ
Heart Risk View-F
Heart Risk View-F(HRV-F)は、心電図同期心筋SPECT 画像をもとにした心機能解析ツールである。
壁運動・壁厚増加率のPolar mapや3D表示、左室容量曲線による心機能指標の算出、位相解析による左室同期不全の評価が可能である。
HRV-Sと組み合わせることで、より詳細なリスク層別化が可能となり、早期血行再建によって予後改善が期待できる患者の同定に有用と報告されているh,i)。

