近年、製薬企業においては、国の承認と異なる方法で医薬品が製造されたことや副作用報告の遅延などにより行政処分が相次いで起こっています。したがって、企業ガバナンスの強化、製薬業界としての信頼回復が求められています。当社は、LQS(品質安全責任)基本方針に「”最高の品質を提供する”との理念に基づき、品質の確かな、安心して使用できる製品とサービスを安定的に供給することにより、人の健康・福祉に貢献する」を掲げ、信頼性の向上に取り組んでいます。組織面では、2016年4月に信頼性保証室を新設し体制を強化しました。信頼性保証室は、総括製造管理者の監督の下に、品質保証責任者または国内品質業務運営責任者、安全管理責任者を置き、製造販売業三役の連携強化を図ることはもとより、品質保証および安全管理のそれぞれに業務を担当する部長を置いて専門性を高めるとともに、相互に密接な連携を図っていく体制といたしました。当社製品の品質および有効性、安全性を担保する信頼性保証体制を強化し、関係する部門とともに更なる信頼性確保に努めています。 住友化学株式会社、住友ファーマ株式会社および当社の3社合同で、2013年4月からGMP情報交換会を開催しています。これまで5回の情報交換会を開催し、品質リスクマネジメント、データ完全性への取り組みなどを議題として、情報の共有を図り、課題の解決に向けた協議を行いました。 近年、製薬企業において、医薬品の副作用報告義務違反が散見され、製造販売後の安全管理業務に関する法令遵守の徹底が求められております。当社においては、安全管理業務に係る社内体制ならびに未報告の副作用がないかを確認する自主点検を定期的に行っており、法令順守の徹底に努めています。 医薬品は有効性とともに一定のリスク(副作用)を伴うものであり、リスクを可能な限り低減し、有効性を最大限に発揮させる方策を講じていくことが必要となります。医薬品リスク管理計画(RMP)とは、医薬品の安全性及び有効性に係る情報収集、調査、試験その他医薬品を使用することに伴うリスクの最小化を図る活動を実施するとともに、その結果に基づく評価及び必要な措置を講ずることにより、適切なリスク管理を行うことをいいます。2013年4月以降に製造販売承認を申請する新医薬品はRMPを策定する必要があり、当社ではビザミル静注の製造販売承認申請に際してRMPの準備を行いました。RMPは製品の販売に伴い公表され、医療関係者の皆様と市販後のリスク管理の内容を広く共有することで、市販後の安全対策の一層の充実強化が図られることが期待されています。RMPにより製品の適正使用が推進され、更なる信頼性向上に努めます。 当社製品(輸入している医療機器)のラベル表示に誤記載が発生しました。海外製造所におけるラベル情報入力ミスと確認漏れ、および国内製造所における確認漏れで7病院へ出荷したもので、直ちに誤表示製品を全て特定し、自主回収を実施しました。このような事態の再発を防止するため、海外製造所での確認体制の強化、および国内製造所での出荷試験の確認項目と記録書式を明確にし、手順化しました。また、本回収についての監督官庁への対応を適宜行いました(2016年7月終了)。 厚生労働省からの通知(「医薬品の製造販売承認書と製造実態の整合性に係る点検について」薬生審査発0119第1号)に従い、当社が製造販売する全ての医薬品の点検を実施しました。調査の結果、製造実態と承認書の内容に相違が認められた品目については2016年5月までに記載整備届の提出を完了しました。点検で相違が認められた事項については、安全性上の問題はありませんでしたが、今後このような事態の再発を防止するため、2016年10月から3件の改善策の運用を開始しました(①点検体制の強化、②変更管理の強化、③承認書関連文書作成の部門間確認強化)。住友化学・住友ファーマとの情報交換
関連する法規を順守した業務遂行
医薬品リスク管理計画に基づく適正使用の推進
自主回収の実施(2016年3月)
承認書と製造実態の整合性点検(2016年1月~)
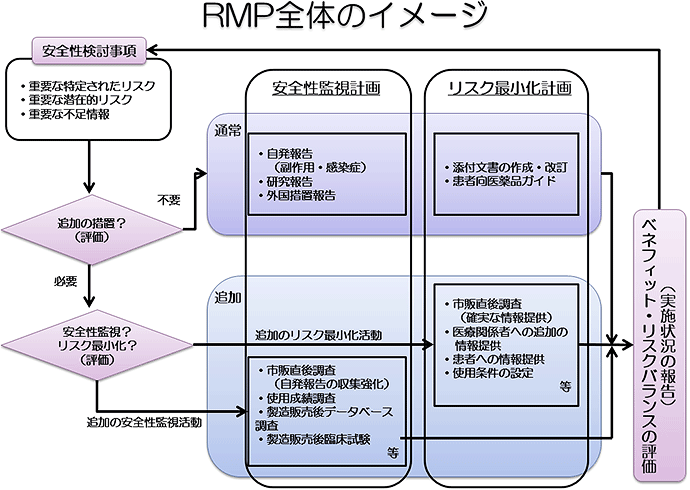 出典:独立行政法人医薬品医療機器総合機構ホームページ
出典:独立行政法人医薬品医療機器総合機構ホームページ
![]()
当サイトの内容について
このサイトで提供されている製品情報は、当社の医療用医薬品等についての一般的な情報の提供を目的としています。したがって、このサイトの情報は、医学的アドバイスや当社の医療用医薬品等の使用説明ではありませんし、医師・薬剤師等の医療従事者の方が、患者の医療に関する決定のため、患者と相談されることに代替するものでもありません。また、このサイトに記載されている製品(開発品を含む)の情報は、その製品またはその効能を宣伝・広告するものではありません。
このサイトで提供されている製品情報は、日本の承認内容に基づき、日本国内での使用に対する医療関係者向けの情報です。日本国外からアクセスされている場合には、このサイトで提供されている製品情報は適切でない可能性があります。現在、居留または滞在されている国での承認の有無および承認内容をご確認ください。